Kvinnelig genital schistosomiasis – et neglisjert globalt kvinnehelseproblem
Publisert 20. desember 2024
Solrun Søfteland
Cand.med, PhD-kandidat, Institutt for klinisk medisin, Universitetet i Oslo/Avdeling for Global helse, Oslo Universitetssykehus
Ameli Tropé
Dr.Med. Overlege/Seksjonssjef, Livmorhalsprogrammet, Kreftregisteret, FHI
Santiago Martinez
PhD, Assisterende professor, Institutt for helse- og sykepleievitenskap, Universitetet i Agder
Svein Gunnar Gundersen
Dr.Med., Professor emeritus, Institutt for global utvikling og samfunnsplanlegging, Universitetet i Agder
Eyrun Kjetland
Dr.Med., Professor, Forskningsgruppeleder, Avdeling for Global helse/Infeksjonsavdelingen, Oslo Universitetssykehus, Discipline of Public Health Medicine, University KwaZulu-Natal, Sør-Afrika
Anne Cathrine Staff
Dr.Med., Professor, Forskningsleder, Institutt for klinisk medisin, Universitetet i Oslo, Kvinneklinikken, Oslo Universitetssykehus
Oppsummert:
Kvinnelig genital schistosomiasis, på engelsk Female Genital Schistosomiasis (FGS), er en neglisjert kvinnesykdom som er endemisk i store deler av Afrika. Grunnet manglende kunnskap hos helsepersonell og befolkningen generelt, er dette en underdiagnostisert og underbehandlet sykdom globalt, lokalt i endemiske land, og i ikke-endemiske land som Norge. Gynekologer, fastleger og jordmødre i Norge kan møte denne sykdommen hos innvandrere fra de fleste land i Afrika, også de som har bodd i Norge i mange år, og hos mennesker som har vært turister i endemiske områder.
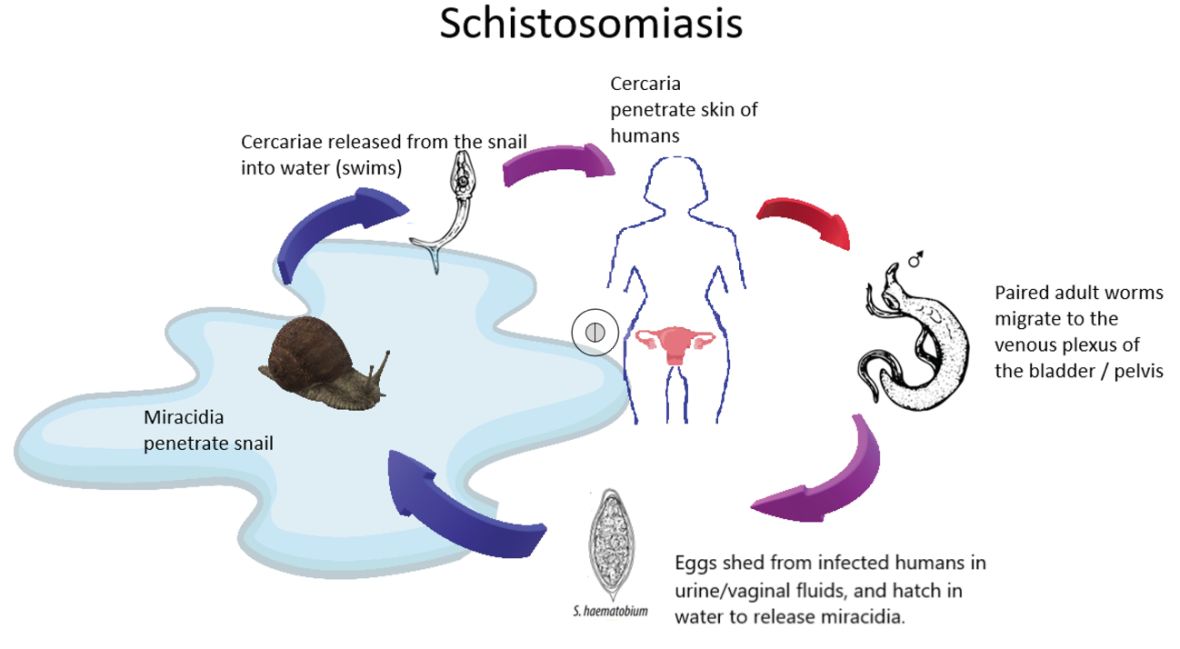
Schistosomiasis
Schistosomiasis, også kjent som bilharzia, er en vannbåren parasittsykdom endemisk i 78 land i verden. I subtropiske og tropiske områder er dette vanlig; 700 millioner mennesker er i risiko, og 250 millioner trenger behandling (1). Mennesker smittes via kontakt med ferskvannskilder, slik som ved bading, fisking og klesvask. Parasitten i ferskvann måler 0.5 cm og penetrerer hel hud ved vannkontakt. I kroppen vil den gå i sirkulasjonen før den etablerer seg på seg predileksjonssted (2). Hunn- og hannparasitt parrer seg inne i menneskets kropp og starter et langt liv med produksjon av egg. Vanlig levetid for parasitt i kroppen er fem år, men man har sett tilfeller der den har overlevd i 40 år. En andel av eggene vil komme ut av kroppen via urin og avføring. Deretter fortsetter livssyklusen når eggene ender opp i ferskvannskilder og utvikler seg til ormer i vann, som igjen kan infisere mennesker (3).
Schistosomiasis er sterkt forbundet med fattigdom og livsstil. Livssyklusen til parasitten er avhengig av mennesket som hovedvert. Mangel på sanitæranlegg og rent vann er derfor obligat for at infeksjon kan forekomme i befolkningen.
Schistosomaparasitten kan i prinsippet affisere alle menneskets indre organer, og det finnes fem subtyper med forskjellige predileksjonssteder (1). I vår tid er det Afrika sør for Sahara som bærer den største sykdomsbyrden. Her bor 90% av mennesker som er i behov av forebyggende behandling (1). Schistosoma haematobium gir urogenitale plager mens Schistosoma mansoni hovedsakelig affiserer mage-tarmtraktus og lever (2).
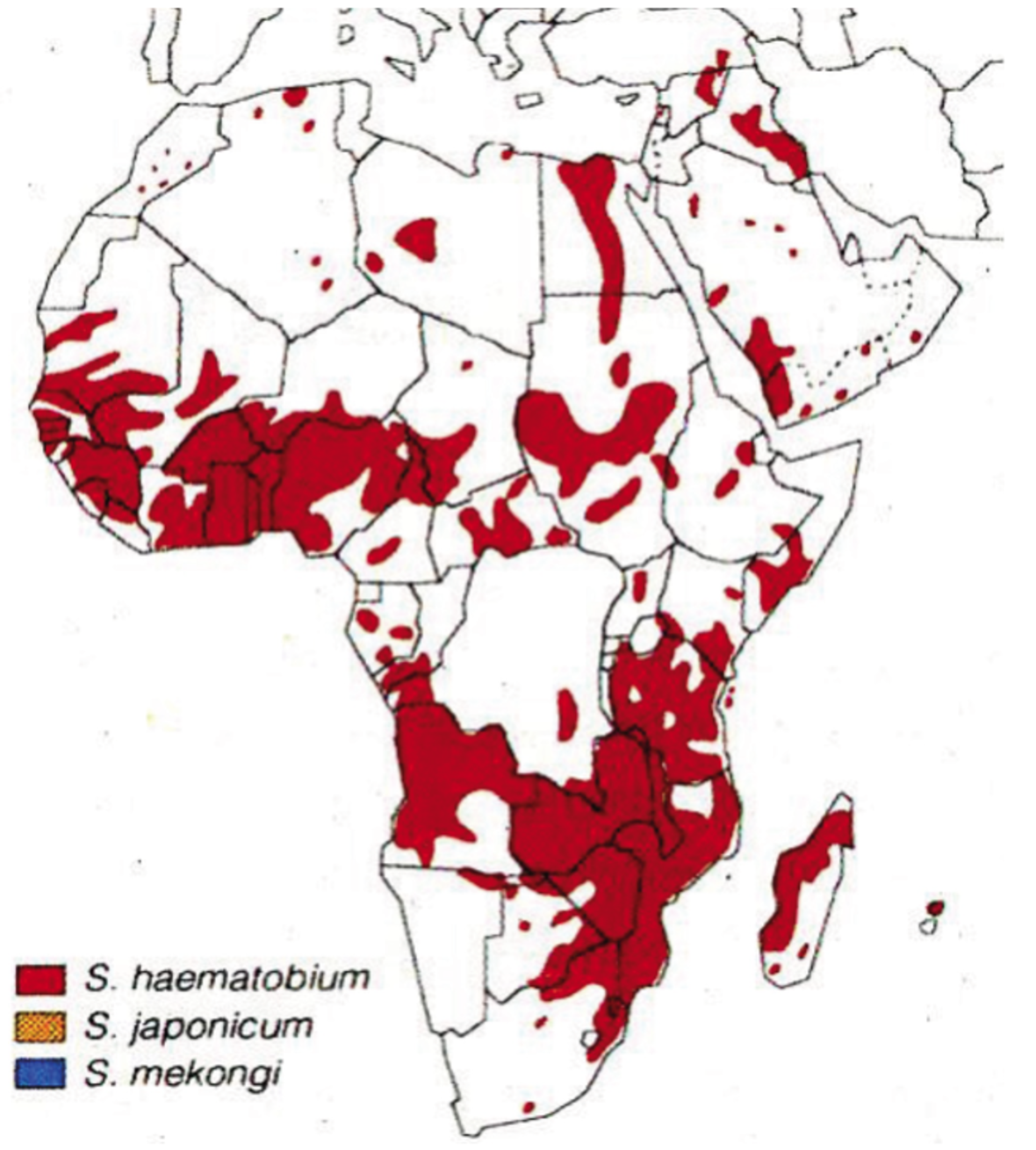
Female genital schistosomiasis
Det har vært kjent i årtusener at schistosomaparasitten kan gi sykdom i mange av kroppens organer. I Egypt har man funnet spor av schistosomiasis i blæren til mumier (4). På slutten av 1800-tallet dokumenterte F. Madden at det også finnes egg og inflammasjon i genitalt vev (5). I en patologistudie fra 1949 fant M. Gelfand egg i alle deler av gynekologiske organer (6). Likevel har det medisinske miljøet i stor grad vært uvitende om dette fenomenet, som nå er et eget fokusområde for WHO på grunn av den betydelige negative effekten det har på kvinnehelse globalt. 300 millioner jenter og kvinner er i risiko. Jenter i endemiske områder kan bli eksponert allerede tidlig i barneårene, og går inn i tenårene med kroniske skader i underlivsorganene.
Symptomer
Det er hovedsakelig kroppens inflammatoriske respons mot parasitteggene som skaper symptomer, og dette kan gi et bredt spekter av symptomer og plager, avhengig av anatomisk lokalisasjon. Pasienter klager over stinkende og misfarget utflod, blødning etter samleie, dyspareuni og kroniske bekkensmerter (7).
Funn/diagnose
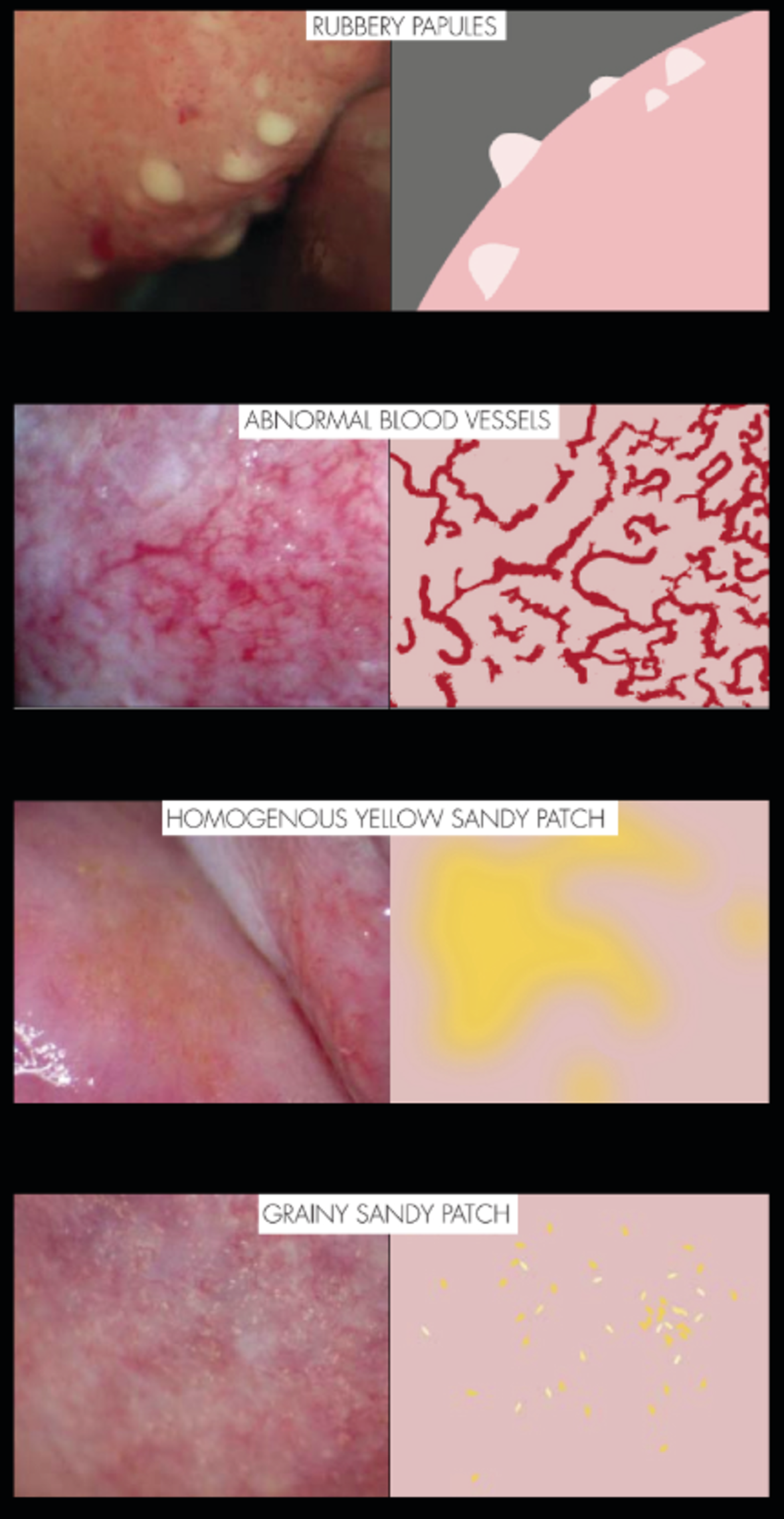
Diagnostisering av Female Genital Schistosomiasis (FGS) baserer seg på visuell inspeksjon av cervix og vaginalvegg. Flere laboratoriemetoder er i bruk, men ingen er vist å være sensitive nok. Forandringene i vevet kan være små, og krever kolposkop for å kunne visualiseres godt nok.
Vi kategoriserer FGS-lesjonene i fire hovedtyper ut ifra utseende (8):
1) «Grainy sandy patches»
2) «Homogenous yellow sandy patches»
3) «Abnormal blood vessels»
4) «Rubbery papules»
Lesjonene kan finnes alene eller sammen. Unormale kartegninger finnes ofte samtidig, men ikke nødvendigvis på akkurat samme sted, som andre lesjoner.
Komplikasjoner/konsekvenser
FGS er sjelden en dødelig sykdom, men kan ha flere alvorlige komplikasjoner. Det er funnet en tre til fire ganger økt risiko for HIV-infeksjon hos kvinner som lever med FGS (9-11). FGS er assosiert med økt risiko for ekstrauterint svangerskap og spontanabort (12-14). En eventuell kausal sammenheng mellom FGS-forekomst og HPV-lesjoner er ikke godt nok studert ennå. Det er også sett høy forekomst av seksuelt overførbare infeksjoner (SOI) hos kvinner med FGS (15,16).
Behandling
Det finnes en effektiv behandling mot schistosomiasis. Det anti-helmittiske midlet Praziquantel brukes både til massebehandling og som behandling ved akutt infeksjon (17). Imidlertid er det usikkerhet rundt effekten på de kroniske inflammatoriske forandringene man ser i underlivet ved FGS. Siden Praziquantel dreper parasitten, vil man forebygge opphopning av nye egg i vevet. Eggene blir imidlertid værende i vevene upåvirket av medikamentet og fortsetter å lage lesjoner og symptomer i uker og måneder til eggene dør av seg selv. Dessverre er befolkningene som er mest affisert av dette vanligvis tvunget til å fortsette å bruke skittent og infisert vann, og vil derfor ofte ble re-infisert gjennom hele livet.
Men er dette relevant i Norge?
Alle mennesker som har hatt kontakt med infiserte ferskvannskilder i endemiske land har risiko for schistosomiasis. Det finnes ikke oppdaterte kart med detaljert oversikt over infiserte vannkilder, men schistosomiasis er endemisk ved store turistattraksjoner som Nilen og Lake Malawi (18). Nordmenn som har vært på reise i endemiske områder kan presentere med akutt febersykdom fire til seks uker etter eksponering, og kan også være uheldig og få underlivsaffeksjon. Det er også sett tilfeller blant mennesker har vært på ferie i Sør-Europa, nærmere bestemt Portugal, Spania og Corsica (20,21).
Hos immigranter fra landsbygda i Afrika sør for Sahara, vil FGS være en viktig differensialdiagnose ved kroniske underlivssymptomer. Hos en pasient med infertilitet som har vokst opp i et endemisk land, vil undersøkelse for schistosomiasis være en viktig del av utredningen. Parasitten kan overleve i kroppen i opptil 40 år, og selv etter at parasitten er død kan inflammatoriske forandringer persistere (22).
Vårt forskningsprosjekt: DUALSAVE-FGS
Vi skriver her på vegne av vår forskningsgruppe: DUALSAVE-FGS, et EU-finansiert multinasjonalt prosjekt med hovedmål om å utvikle et nytt diagnoseverktøy for FGS. Vår samarbeidspartner QCELL (https://qcell.tech ) har utviklet et nytt kolposkop. Dette håndholdte utstyret tar høyoppløselige konvensjonelle bilder, men i tillegg også såkalte multispektrale bilder basert på alle lysets bølgelengder. Denne metoden er allerede validert for livmorhalsscreening, og den kan visualisere forandringer som ligger noen millimeter ned i vevet. Målet er å utvikle et billig kolposkop som gir diagnosestøtte for FGS og er brukbart i lavinntektsland for både leger og sykepleiere.
Et annet viktig mål i vårt prosjekt, er å utvikle opplæringsmateriell og spre kunnskap om FGS. Vi vil nå utvikle et digitalt kurs som vil være tilgjengelig på nettsiden WHO Open. Vi holder på å utvikle en mobilbasert app for øvelse i gjenkjenning av lesjoner ved kolposkopi.
Hva kan en kliniker i Norge gjøre?
Det er lite informasjon å finne om FGS både i faglige retningslinjer lokalt i Norge, men også globalt og i endemiske land. I Oslo universitetssykehus sin metodebok for Infeksjonsmedisin får man et raskt overblikk over schistosomiasis generelt (https://metodebok.no/index.php ). Vi jobber med å lage et FGS-kapittel til Norsk Veileder i Gynekologi. Etter hvert vil vi jobbe med kompetanseheving også blant norske allmennleger, sykepleier og jordmødre.
I mellomtiden kan spørsmål rettes til: Amelie Tropé (email: amtr@kreftregisteret.no ) og Eyrun Kjetland (email: e.f.kjetland@medisin.uio.no ). På vår informasjonsside https://fgsnomore.org finnes det overordn et informasjon om prosjektet. For klinisk støtte når man ser etter lesjoner er WHO Pocket Atlas for FGS gjeldende konsensus (https://www.who.int/publications/i/item/9789241509299, ISBN 978 92 4 150922 9 )
Call for action
Målet vårt med denne teksten er å spre kunnskap om dette neglisjerte temaet blant helsepersonell i Norge. Selv om schistosomiasis ikke er endemisk i Norge, er dette et stort globalt problem som et resultat av fattigdom og manglende fokus på kvinnehelse. Første steg er økt bevissthet hos helsepersonell, og vi har laget en flyer som kan spres på legekontorer og lunsjrom.
Last ned brosjyren



Foto: Håvard Holme og Hedda Wegger
Referanser
- WHO Schistosomiasis fact sheet. WHO.int [Internett]. [oppdatert 01.feb 2023; hentet 2. nov 2024]. Tilgjengelig fra: https://www.who.int/news-room/fact-sheets/detail/schistosomiasishttps://www.who.int/news-room/fact-sheets/detail/schistosomiasis
- Schistosomiasis: Epidemiology and clinical manifestations. UpTpDate [Internett]. [oppdatert 31. mai 2023; hentet 2. nov 2024]. Tilgjengelig fra: https://www-uptodate-com.ezproxy.uio.no/contents/schistosomiasis-epidemiology-and-clinical-manifestations?search=schistosomiasis&source=search_result&selectedTitle=1%7E90&usage_type=default&display_rank=1
- CDC Schistosomiasis. Centre for Disease Control [Internett]. [oppdatert 17.juni 2024; hentet 2. nov 2024]. Tilgjengelig fra: https://www.cdc.gov/schistosomiasis/index.html
- Barakat, R. M. R. (2013). Epidemiology of Schistosomiasis in Egypt: Travel through Time: Review. Journal of Advanced Research, 4(5), 425–432. https://doi.org/10.1016/j.jare.2012.07.003
- Madden, F. (1899). A CASE OF BILHARZIA OF THE VAGINA. Lancet, 153(3956), 1716–1716. https://doi.org/10.1016/S0140-6736(01)51385-9
- Gelfand, M. (1949). Schistosomiasis of the female genital tract. South African Medical Journal, 23(14), 255–257.
- Kjetland, E. F., Leutscher, P. D. C., & Ndhlovu, P. D. (2012). A review of female genital schistosomiasis. Trends in Parasitology, 28(2), 58–65. https://doi.org/10.1016/j.pt.2011.10.008
- Female genital schistosomiasis: A pocket atlas for clinical health-care professionals. WHO.int [Internett]. [oppdatert 15.mai 2015; hentet 2. nov 2024]. Tilgjengelig fra: https://www.who.int/publications/i/item/9789241509299
- Downs JA, Dupnik KM GJ, Urassa M, Lutonja P, Kornelis D, et al. Effects of schistosomiasis on susceptibility to HIV-1 infection and HIV-1 viral load at HIV-1 seroconversion: A nested case-control study. PLoS Negl Trop Dis. (2017) 11:1–15. doi: 10.1371/journal.pntd.0005968
- Brodish PH, Singh K. Association between Schistosoma haematobium exposure and Human Immunodeficiency Virus infection among females in Mozambique. Am J Trop Med Hyg. (2016) 94:1040–4. doi: 10.4269/ajtmh.15-0652
- Kjetland, E. F., Ndhlovu, P. D., Gomo, E., Mduluza, T., Midzi, N., Gwanzura, L., Mason, P. R., Sandvik, L., Friis, H., & Gundersen, S. G. (2006). Association between genital schistosomiasis and HIV in rural Zimbabwean women. AIDS, 20(4), 593–600. https://doi.org/10.1097/01.aids.0000210614.45212.0a
- Bustinduy AL, Randriansolo B, Sturt AS, Kayuni SA, Leustcher PDC, Webster BL, et al. An update on female and male genital schistosomiasis and a call to integrate efforts to escalate diagnosis, treatment and awareness in endemic and non-endemic settings: The time is now. Adv Parasitol. (2022) 115:1–44. doi: 10.1016/ bs.apar.2021.12.003
- Kjetland EF, Kurewa EN, Mduluza T, Midzi N, Gomo E, Friis H, et al. The first community-based report on the effect of genital Schistosoma haematobium infection on female fertility. Fertil Steril. (2010) 94:1551–3. doi: 10.1016/j.fertnstert.2009.12.050
- Miller-Fellows SC, Howard L, Kramer R, Hildebrand V, Furin J, Mutuku FM, et al. Cross-sectional interview study of fertility, pregnancy, and urogenital schistosomiasis in coastal Kenya: Documented treatment in childhood is associated with reduced odds of subfertility among adult women. PLoS Negl Trop Dis. (2017) 11: e0006101–e0006101. doi: 10.1371/journal.pntd.0006101
- Shukla, J. D., Kleppa, E., Holmen, S., Ndhlovu, P. D., Mtshali, A., Sebitloane, M., Vennervald, B. J., Gundersen, S. G., Taylor, M., & Kjetland, E. F. (2023). The Association Between Female Genital Schistosomiasis and Other Infections of the Lower Genital Tract in Adolescent Girls and Young Women: A Cross-Sectional Study in South Africa. Journal of Lower Genital Tract Disease, 27(3), 291–296. https://doi.org/10.1097/LGT.0000000000000756
- Galappaththi-Arachchige HN, Zulu SG, Kleppa E, Lillebo K, Qvigstad E, Ndhlovu P, et al. Reproductive health problems in rural South African young women: Risk behaviour and risk factors. Reprod Health. (2018) 15. doi: 10.1186/ s12978-018-0581-9
- Schistosomiasis: Treatment and manifestations. UpTpDate [Internett]. [oppdatert 03. mai 2023; hentet 2. nov 2024]. Tilgjengelig fra: https://www-uptodate-com.ezproxy.uio.no/contents/schistosomiasis-treatment-and-prevention?search=schistosomiasis%20treatment&source=search_result&selectedTitle=1%7E90&usage_type=default&display_rank=1
- Kristiansen, T., Pettersen, F. O., Lier, T., Hinderaker, S. G., Greve, G., & Mørch, K. (2021). Schistosomiasis hos norske studenter etter opphold i Afrika. Tidsskrift for Den norske lægeforening, 141(3), 1–8. https://doi.org/10.4045/tidsskr.20.0268
- Clerinx, J., & Van Gompel, A. (2011). Schistosomiasis in travellers and migrants. Travel Medicine and Infectious Disease, 9(1), 6–24. https://doi.org/10.1016/j.tmaid.2010.11.002
- Boissier, Jérôme, Dr, Grech-Angelini, Sébastien, MD, Webster, Bonnie L, PhD, Allienne, Jean-François, BSc, Huyse, Tine, PhD, Mas-Coma, Santiago, PhD, Toulza, Eve, PhD, Barré-Cardi, Hélène, PhD, Rollinson, David, PhD, Kincaid-Smith, Julien, MSc, Oleaga, Ana, PhD, Galinier, Richard, PhD, Foata, Joséphine, PhD, Rognon, Anne, MSc, Berry, Antoine, MD, Mouahid, Gabriel, PhD, Henneron, Rémy, MD, Moné, Hélène, PhD, Noel, Harold, MD, & Mitta, Guillaume, PhD. (2016). Outbreak of urogenital schistosomiasis in Corsica (France): an epidemiological case study. Lancet. Infectious Diseases/The Lancet. Infectious Diseases, 16(8), 971–979. https://doi.org/10.1016/S1473-3099(16)00175-4
- Gabrielli, A. F., & Garba Djirmay, A. (2023). Schistosomiasis in Europe. Current Tropical Medicine Reports, 10(3), 79–87. https://doi.org/10.1007/s40475-023-00286-9
- Chabasse, D., Bertrand, G., Leroux, J. P., Gauthey, N., & Hocquet, P. (1985). Developmental bilharziasis caused by Schistosoma mansoni discovered 37 years after infestation. Bulletin de la Societe de pathologie exotique et de ses filiales, 78(5), 643.




